6.イオンマイグレーションのメカニズム
イオンマイグレーション現象は基本的には水溶液中の電気化学現象であり、湿ったイオンマイグレーションもミクロ的には水溶液中の反応と考えられる。そしてイオンマイグレーションは、「金属の溶解」、「金属イオンの移動」、「金属として析出」の3つの現象に分けることが出来る。
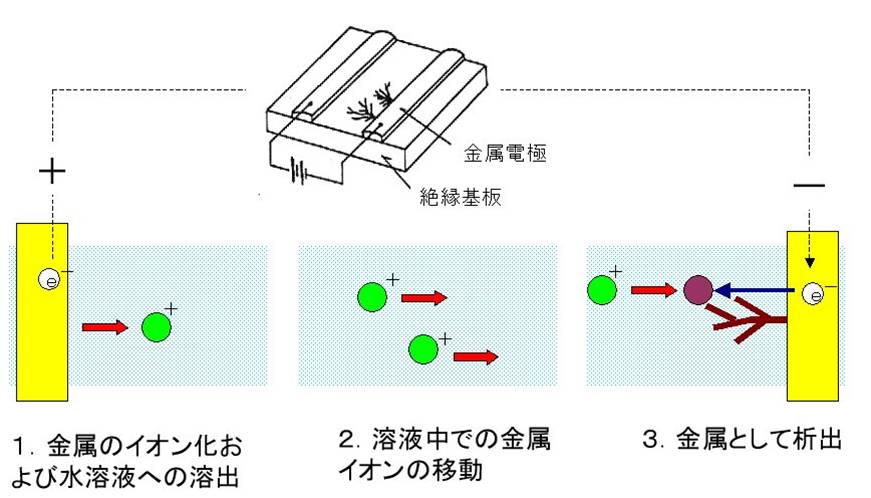
- (6.1) 金属の溶解
- 水溶液に接する金属は、水溶液中の酸化剤などにより化学電子を失ってイオン化し、さらに金属イオンは水溶液中の配位子と反応して錯体を作り、水溶液に溶出する(アノード反応)。この時、水溶液中の酸化剤(酸素など)が電子を受け取る(カソード反応)。この反応系は本質的に化学電池反応と同じで、全アノード電流と全カソード電流は同じである(局部電池モデル)。またpHによっても溶解傾向が変わることが知られている。
- (6.2) イオンの移動
- 電界が加わった溶液系にあるイオンは、イオンの内部電位に働く力による電気泳動現象および物質の濃度差による拡散現象によって電極間を移動する。イオンマイグレーション現象においては電気泳動現象の影響が大きいが、イオンが移動するためには、水分子の厚みがある程度必要であり、湿ったIMではデンドライト成長の長さが時間的に一様でないことより、電極間は一様な厚みの溶液ではないと考えられるので、無限希釈液中の銀イオンの移動度に比べて遅くなる。
- (6.3) 金属として析出
- 電気化学反応により金属が析出する場合のデンドライトは拡散率速凝集(Deffusion Limited Aggregates)モデルで説明される。イオンマイグレーション現象により発生するデンドライトの場合、時間的なフラクタル次元が電界によって異なることより、電界は物質供給機構(銀の移動)に関わっているものと考えられる。デンドライト形状のフラクタル次元は、電界が変わってもほぼ同じであり、物質供給機構の差による相違がほとんど無いことを示している。すなわち、電界によってイオンはデンドライトの近くに運ばれ、電極に到達したイオンは即金属として析出しているものと思われる。
 前へ戻る
前へ戻る
 次へ
次へ
 前へ戻る
前へ戻る
 次へ
次へ